دگرسانی(variations) داروهای ژنریک
مقدمه :
در بین دست اندرکاران امور دارو و درمان و نیز مصرف کنندگان عقیده نادرستی وجود دارد مبنی بر اینکه داروهای ژنریک مجاز هستند تا 20% از داروهای برند مشابه در محدوده جذب و سطح درمانی متفاوت باشند . دلیل این طرز فکر غلط ، برداشت نادرست از الزاماتی است که بر اساس آن با بازه اطمینان(coefficient interval) 90% ، میانگین سرعت و مقدار جذب داروهای ژنریک باید بین 80% تا 125% میزان و سرعت جذب داروی برند مرجع باشد تا هم ارزبالینی معرفی شوند . این مقاله هم ارزی درمانی از نقطه نظر FDA و سازمان سلامت کانادا برای تائید داروهای ژنریک را بازبینی می نماید.
شرایط ضروری تائید داروهای ژنریک:
برای اینکه یک داروی ژنریک شرایط تائید FDA را احراز کند شرکت تولید کننده باید ، درخواست برای تائید داروی جدید (ANDA) Abbreviated New Drug Application را به FDA تسلیم کند و برای اینکه یک داروی ژنریک اجازه فروش و عرضه در بازار را پیدا کند باید سه شرط زیر را داشته باشد :
· از لحاظ ارزش درمانی با داروی برند نوآور یکسان باشد .
· الزاماتی که برای شناسایی هر بچ محصول مطرح است مشتمل بر شناسایی ، قدرت ، خلوص و کیفیت یکسان باشد .
· تولید داروی ژنریک تحت استانداردهای دقیق FDA و قوانین مصوب برای تولید داروی برند باشد .
هر فرآورده دارویی برای اینکه از نظر درمانی هم ارز شناخته شود باید از لحاظ دارویی هم ارز باشد . از نظر FDA داروهایی از نظر دارویی هم ارز هستند که دارای مواد مؤثره یکسان ، شکل دارویی و راههای مصرفی یکسان بوده و نیز از نظر غلظت و قدرت یکسان باشند . محصولاتی هم ارز درون تن هستند که هم ارز بالینی (مقدار و میزان جذب آنها) بوده و این مهم با مطالعات در شرایط یکسان محرز شده باشد.
علم آمار هم ارزی درون تن را مشخص می کند . بدین معنا که از نظر میزان و سرعت جذب تفاوت عمده ای بین محصول ژنریک و برند وجود نداشته باشند .
عموماً در موارد ارائه درخواست داروهای ژنریک برای اطمینان از بی ضرری دارو و اثر بخشی آن ضرورتی به ارائه اطلاعات بالینی (انسانی) و قبل از بالینی (حیوانی) نمی باشد. در عوض درخواست کنندگان داروهای ژنریک باید هم ارزی درون تن داروی تولید شده با داروی مرجع اولیه را مشخص نمایند .
برای اینکه یک محصول دارویی ژنریک بتواند تائیدیه سلامت کانادا را کسب نماید باید فرم درخواست داروی جدید ANDS (Abbreviated new drug submission) که مدلل هم ارزی درون تن باشد را ارائه دهد و داروها نیز باید از نظر دارویی هم ارز بوده و تحت استانداردهای دقیق GMP تولید شوند.
هم ارزی زیستی
بازه اطمینان ، محدوده ای آماری بوده که قابل اندازه گیری است. این محدوده شامل احتمال کنترل یا شناخته شده از بروز واقعیت است (در این مورد تا 90%). از نظر FDA داروها زمانی هم ارز درون تن شناخته می شوند که در بازه اطمینان 90% ، میانگین AUC (منطقه زیر منحنی زمان به غلظت) و میانگین نسبی Cmax (ماکزیمم غلظت) برای دارو تحت آزمایش بین 80% تا 120% (یا 80% تا 125% بر اساس اطلاعات لگاریتمی) نسبت به محصول مرجع باشد. این شاخص در سال 1986 بعد از سه روز جلسه علنی متخصصین در مورد بررسی روشهای FDA برای تعیین هم ارزی درون تن داروهای ژنریک جامد خوراکی سریع رهش (immediate release) مشخص گردید. این دقیقاً همان استانداردی است که برای تشخیص هم ارزی درون تن داروهای برند که تغییر فرمولاسیون یا تغییراتی در مراحل تولید داشته اند ، بکار می رود. تا امروز هیچگونه اطلاعات بالینی در جهت کمتر نمودن بازه اطمینان 80% تا 125% برای هر نوع دارو یا دسته دارویی به FDA تسلیم نشده است . چنانچه بازه اطمینان نزدیک تری مد نظر قرار گیرد این احتمال وجود دارد که در مورد داروهای برندی که تغییر فرمولاسیون داده شده اند لزوما هم ارز با برند اولیه نباشند. از نظر اداره سلامت کانادا داروهای ژنریک باید هم ارزی زیستی با داروی مرجع داشته باشند . این هم ارزی زیستی داروها از نظر سازمان سلامت کانادا شامل دو حالت زیر است :
· با بازه اطمینان 90 % ، میانگین نسبی سطح زیر منحنی (AUC) برای نمونه باید 80% تا 125% محصول مرجع باشد .
· میانگین نسبی غلظت ماکزیمم (Cmax) نمونه باید بین 80% تا 125% محصول مرجع باشد .
در مورد الزامات هم ارزی زیستی داروها از نظر اداره سلامت کانادا برخی استثناها نیز مانند موارد زیر وجود دارد :
مثلاً داروهایی با مقادیر آزاد سازی اصلاح شده ، داروهایی با فارماکوکینتیک متفاوت ، داروهایی که زمان شروع اثر یا میزان جذب در آنها مهم است ، داروهایی با اثر سمیت بالا و یا اندیکس درمانی باریک (narrow therapeutic range) ، موارد با جذب بسیار کم یا فقدان جذب ، زمانیکه روشهای موجود برای اندازه گیری غلظت دارو در خون برای حداقل سه نیمه عمر به میزان کافی حساس و قابل اعتماد نباشد و نیز در موارد داروهای بیولژیکی .
برای داروهایی با مقدار مصرف بحرانی (داروهایی با اندیکس درمانی باریک مثل cyclosporine ، digoxin ، flecainide ، lithium ، phenytion ، sirolimus ، tacrolimus ، warfarin و theophylline . اداره سلامت کانادا ملزم کرده است با بازه اطمینان 90% ، AUC باید بین 90% تا 112% باشد و با بازه اطمینان 90% Cmax نیز بین 80% تا 125% باشد . این الزامات باید تحت شرایط ناشتا بودن و غذا خوردن در نظر گرفته شود . مطالعات steady-state در داروهای با مقدار مصرف بحرانی الزامی ندارد مگر اینکه با ذکر استثنائات تضمین کافی داده شود . اگر مطالعه steady-state مورد نیاز باشد با بازه اطمینان 90 % میانگین نسبی غلظت حداقل (Cmin) برای نمونه باید 80% تا 125% داروی مرجع باشد . بعلاوه اداره سلامت کانادا توصیه می کند ترجیحاً از بیماران به جای افراد سالم در مطالعات هم ارزی زیستی برای داروهای با مقدار مصرف بحرانی استفاده شود .
به دلیل غیر ممکن بودن جمع آوری اطلاعات از کل جمعیت ، دانشمندان علم آمار به ناچار اطلاعات گروهی از مردم را برای همه تعمیم می دهند . بازه اطمینان تخمینی از خطای موجود در بررسی گروه محدودی از جمعیت را ارائه می دهد . این اعداد در مورد دقت موجود در تخمین های آماری محاسبه شده (مثلاً میانگین انحراف استاندارد و همبستگی) به ما اطلاعات بیشتری می دهند. در ارزیابی هم ارزی زیستی ، بازه اطمینان 90% به این معناست که با ضریب 90% میانگین صحیح AUC و Cmax برای کل جمعیت بین حداقل و حداکثر بازه اطمینان محاسبه شده خواهد بود .
برای نمونه مورد آزمایش جهت هم ارزی زیستی بازه اطمینان محاسبه شده باید بین 80% تا 125% محصول مرجع باشد . جهت ارزیابی هم ارزی زیستی FDA و اداره سلامت کانادا دو روش آزمون one-sided را انجام می دهند بطوری که محاسبه بازه اطمینان برای نسبت بین مقادیر متوسط نمونه مورد آزمایش و نمونه مرجع را در بر گیرد . عدد ذیل (که از FDA اقتباس شده) اختلاف پیامدهای احتمالی هم ارزی زیستی را تعیین می کند .
![]() :
محدوده اطمینان برای نسبت بین مقادیر متوسط نمونه و مرجع
:
محدوده اطمینان برای نسبت بین مقادیر متوسط نمونه و مرجع
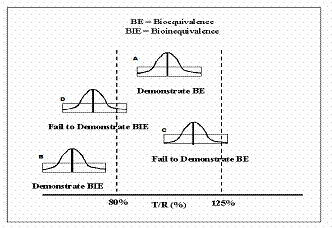
شکل فوق پیامدهای متفاوت احتمالی را نشان می دهد .
A : یک بررسی two-sided با بازه اطمینان 90 % کاملاً بین 80% تا 125% ، هم ارزی زیستی را مشخص می کند .
B: یک بررسی two-sided با بازه اطمینان 90 % کاملاً بیرون از 80% تا 125% نا هم ارزی زیستی را مشخص می کند .
C: یک بررسی با نقطه تخمین بین 80% تا 125% اما بررسی two-sided بازه اطمینان 90 % بیرون از 80% تا 125% و نمی تواند هم ارزی زیستی را مشخص نماید .
D: یک بررسی با نقطه تخمین بیرون از 80% تا 125% است اما بررسی two-sided بازه اطمینان 90 % هم پوشانی با فاصله 80% تا 125% دارد و نمی تواند هم ارزی زیستی را مشخص نماید .
هر دو مورد مردود (D,C) نیاز به مطالعات بیشتر با نمونه های بیشتر داشته تا بتواند به نتیجه قطعی برسد. مطالعات هم ارزی زیستی بر مبنای طراحی متقاطع است بدین صورت که نیمی از افراد مورد مطالعه ابتدا فرآورده مورد آزمایش و سپس بعد از گذشت زمان (Washout) ، محصول مرجع به آنان داده می شود و در بقیه افراد مورد مطالعه دو محصول بصورت بر عکس استفاده می شود . عموماً در مطالعات هم ارزی زیستی حداقل از 12 نفر استفاده می شود . اما چنانچه جذب یا دفع دارو مورد نظر بسیار متفاوت باشد از تعداد بیشتری استفاده خواهد شد . برای هر نمونه مورد بررسی از نمونه های متعدد خون برای تعیین ماکزیمم غلظت دارو (Cmax) ، زمان رسیدن به Cmax (Tmax) و سطح زیر منحنی زمان و غلظت (AUC) استفاده می شود . AUC مقیاسی است برای اندازه گیری میزان جذب دارو ، Cmax مدلل سرعت و مقدار جذب و Tmax به عنوان شاخص میزان جذب عمل می کند.
مثالهای دیگری در ذیل آورده شده که نشان می دهد چگونه بازه اطمینان طبق استانداردهای FDA بکار گرفته می شود تا هم ارزی زیستی را تعیین نماید.
مثلاً نسبت AUC داروی مورد آزمایش به داروی مرجع (AUC آزمون به مرجع) برای داروی A در 6 نفر به صورت زیر است: 120% ، 120% ، 110% ، 110% ، 90% ، 110% و میانگین AUC آزمون به مرجع ، 110% با 90% بازه اطمینان (102 تا 117) می باشد . این بدان معناست که با احتمال 90% مبنی بر وجود میانگین صحیح بین 102% تا 117% وجود دارد . بنابراین دارو در تست هم ارزی زیستی تائید شده و با داروی مرجع هم ارز زیستی می باشد.
در مثال دیگر AUC آزمون به مرجع برای داروی B در 6 نفر به صورت زیر است : 110% ، 190% ، 30% ، 130% ، 90% ، 110% و میانگین AUC آزمون به مرجع 110% و بازه اطمینان 90 % از 75 تا 145 بوده است . با وجودیکه متوسط نسبت AUC آزمون به مرجع یعنی عدد 110% مشابه با این نسبت برای داروی A است . احتمال 90% مبنی بر وجود میانگین حقیقی بین 75% تا 145% وجود دارد . محدوده مطمئن بسیار وسیع است و بنابراین داروی B در بررسی هم ارزی زیستی مردود شده و با داروی مرجع هم ارز نیست .
همانطور که در شکل بالا ذکر گردید بازه اطمینان با محدوده 80% تا 125% به این معنا نیست که سطح دارو بتواند تا 20% بین داروی مرجع (برند) و داروی مورد آزمون (ژنریک) تغییر کند . چنانچه مقادیر دارو بیش از 10% تغییر داشته باشند محدوده مقادیر قابل قبول بین بازه اطمینان 90 % نیز به همان نسبت بسیار وسیع می شود و دارو از نظر تست هم ارزی زیستی مردود و در نتیجه با داروی مرجع یکسان نخواهد بود. در عمل طبق مطالعاتی که به عنوان معیار هم ارزی زیستی توسط FDA مورد استفاده قرار می گیرد ، که مربوط به 224 دارویی است که بعد از سال 1962 طی دوره دو ساله بعد از اصلاحات و تغییرات Waxman Hatch تائید شده اند و مشتمل بر تعدادی داروی با اندیکس درمانی باریک نیز می باشد، مدلل این مهم است که میانگین میزان تغییر در bioavailability بین داروهای برند و ژنریک تنها 5/3% بوده است .
نگرانی جایگزینی با داروهای ژنریک :
هر چند سازمان سلامت کانادا و FDA معتقدند که جایگزینی داروی برند با یک محصول هم ارز موجب بروز اثرات یکسان بالینی و پروفایل بی ضرری یکسان است برخی متخصصین بالینی در مورد تفاوتهای در bioavailability دارو بین داروی ژنریک جایگزین با برند مرجع ابراز می دارند خصوصاً در مورد داروهایی که اندیکس درمانی باریک دارند (مثل وارفارین ، داروهای ضد صرع و ...)
مخالفان جایگزینی داروهای ژنریک در داروهای ضد صرع معتقدند جایگزینی با محصولات ژنریک منجر به افزایش هزینه های درمانی شده و نیز باعث بروز عوارض جانبی می شود . ایشان نگرانند که تفاوت مجاز در bioavailability بین داروهای برند و ژنریک برای داروهایی با اندیکس درمانی باریک بسیار وسیع باشد . همچنین مخالفان در آمریکا اشاره کردند که مطالعات bioavailability بر روی داوطلبان سالم صورت می گیرد که این داوطلبان همزمان داروهای دیگر مصرف نکرده و تنها این دارو را به صورت تک دوز مصرف می نمایند که این امر با شرایط بالینی که هدف آن ایجاد شرایط برای بیمار می باشد متفاوت است. همچنین نگرانی دیگری وجود دارد که بیماران در طی ماههای مصرف دارو نتوانند از یک نوع داروی ژنریک استفاده نمایند و مجبور به دریافت داروهای گوناگون شوند که این امر می تواند خطر مسمومیت یا عود تشنج را در بر گیرد .
گزارشاتی مبنی بر عدم کنترل تشنج یا مسمومیت دارویی بعد از تبدیل داروهای برند به ژنریک و یا بین دو داروی ژنریک وجود دارد . به هر حال مشخص نیست تشدید بروز عود تشنج به دلیل جایگزینی ژنریک داروهای ضد صرع است یا بواسطه عوامل دیگری بروز می کند .
FDA معتقد است معیار فوق برای هم ارزی زیستی داروها یعنی بازه اطمینان بین 80% تا 125% در نظر گرفته شده، حتی برای داروهایی با اندیکس درمانی باریک به انـدازه کافی مناسب است و تا امروز هیچگونه اطلاعاتی خلاف مطلب فوق گزارش نشده است. بعلاوه هیچ دلیلی دال بر تفاوت بین افراد سالم و بیمار در هم ارزی زیستی وجود ندارد. برای داروهای با اندیکس درمانی باریک یا دوز بحرانی، سازمان سلامت کانادا با بازه اطمینان 90% Cmax بین 90% تا 112% را تائید می کند . اخیراً نگرانی در خصوص جایگزینی ژنریک برای فرآورده های آهسته رهش بیشتر شده است که دلیل آن متفاوت بودن فن آوری آزادسازی دارو در زمان برای داروی ژنریک با برند مرجع است. چندین مورد شکایت از عوارض جانبی دارو در اثر جایگزینی Toprol XL و Wellbutrin با نوع ژنریک آنها در اینترنت منتشر شده است.
Consumer lab.Com در پی تحقیقات خود در یافته است در شرایط آزمایشگاهی metoprolol آهسته رهش با میزان متفاوتی حل می شود. با این حال FDA برای تعیین هم ارزی زیستی داروها به میزان انحلال آنها توجهی ندارد. آزمایش انحلال برای داروهای آهسته رهش آزمایش ویژه ای برای هر delivery system است که تنها برای حصول اطمینان از یکنواختی کامل بچ سایزها در خط تولید سازنده استفاده می شود.
Consumer lab.com همچنین اعلام می دارد میزان آزادسازی داروی ژنریک bupropin با داروی برند wellbutrin XL متفاوت است . FDA پس از تست و بررسی متوجه شد که Tmax برای bupropin ژنریک و wellbutrin XL برند متفاوت است. اما با این حال تفاوت Tmax بطور بالینی اهمیت زیادی ندارد زیرا اثر ضدافسردگی در مقادیر steady-state صورت می گیرد .
در مجموع FDA برای انداز گیری سرعت جذب از Cmax به جای Tmax استفاده می کند . Cmax ماکزیمم مقدار دارو را نشان می دهد که این میزان به عنوان دومین شاخص مقدار جذب بعد از AUC مطرح است. در عمل ، آزادسازی داروهای ژنریک با مقادیر متفاوتی صورت می گیرد ، تا زمانیکه انتهای پیک غلظت دارو در محدوده استانداردهای آزمایش باشد. مثلا در مواردیکه Tmax بطور بالینی مطرح نیست مثل مواردیکه تاثیر درمانی وابسته به غلظت در حالت Steady-State است. در مواردی که Tmax بطور بالینی مهم است (مثلاً داروهای رفع سردردهای حاد) FDA جهت محاسبه هم ارزی زیستی Tmax را نیز در نظر می گیرد .
نتیجه :
یک داروی ژنریک برای اینکه اجازه ورود به بازار را کسب کند نیازمند احراز شرایط زیر است : داروی ژنریک باید از لحاظ درمانی با داروی برند مرجع همسان باشد ، تحت قوانین و استانداردهای مناسب و دقیق تولید شود ، الزامات یکسان در بچ از نظر شناسایی ، خلوص ، دوزاژ و کیفیت با داروی برند مرجع داشته باشد .
اخیراً برداشت نادرستی مبنی بر امکان تفاوت 20% بین مقادیر داروهای ژنریک یا در bioavailability آن با برند مرجع ایجاد شده است که دلیل آن عدم برداشت صحیح از درک آمار بکار گرفته شده در ارزیابی هم ارزی زیستی است . در واقع اختلاف bioavailability در بسیاری از داروهای ژنریک با برند مرجع خود در ایالات متحده کمتر از 4% است .
هر چند گزارشاتی مبنی بر وجود عوراض جانبی در بیماران پس از جایگزینی داروهای ژنریک نسبت به داروی برند مرجع وجود دارد اما هیچ دلیلی دال بر اختلاف در کارایی بین داروهای برند و ژنریک که از نظر درمانی معادل هستند وجود ندارد . در نظر داشته باشید که داروهای ژنریک تنها در برابر داروهای برند آزمایش می شوند . بنابراین در ایالات متحده داروهای ژنریک با داروهای برند اختلاف معنی داری ندارند . اما هیچ آزمایشی دال بر هم ارزی زیستی آنها با یکدیگر صورت نمی گیرد .
جایگزینی فرآورده های ژنریک با خصوصیات درمانی معادل موجب صرفه جویی مالی برای بیماران بدون هیچگونه عوارض جانبی می شود . در موارد نادری وقتی داروی ژنریک جایگزین برند می شود عوارض جانبی بروز می کند (به عنوان مثال حساسیت به مواد غیر فعال یا جانبی داروها) . در اینگونه موارد داروی ژنریک یا برند ـ ژنریک دارای مجوز قانونی (دارویی که در حقیقت برند بوده ولی دوباره برچسب گذاری شده و تحت نام ژنریک به بازار عرضه می شود) در صورت در دسترس بودن می تواند در نظر گرفته شود.
به استفاده کنندگان از این مقاله تذکر داده می شود از هر گونه برداشت حرفه ای بالینی از مقاله فوق اجتناب نموده و با سایر منابع مناسب مشورت نمایند تا برداشت بالینی بر روی محتوی این مقاله پیدا نمایند. نویسندگان این مقاله منابع مورد استفاده خود را از بین اطلاعات گرفته شده از متخصصین ، ادارات دولتی و سازمانهای بین المللی استخراج کرده اند. اطلاعات و سایتهای اینترنتی مورد استفاده در زمان چاپ مقاله به روز بوده اند.
Reference: PHARMACIST’S LETTER July 2008 ~ Volume 24 ~ Number 240704